CRISPR-Sequenzierung
CD Genomics bietet eine kosteneffiziente und hochdurchsatzfähige Validierung von CRISPR-Cas9-Knockouts sowie die potenzielle Erkennung von Off-Target-Effekten, indem fortschrittliche Technologien genutzt werden. Next-Generation-Sequenzierung (NGS)Unsere Teammitglieder haben Erfahrung in sowohl der Genom-Editierung als auch in NGS, was umfangreiche Unterstützung für Ihre Forschung ermöglicht.
Was ist CRISPR?
CRISPR, kurz für Clustered Regularly Interspaced Short Palindromic Repeats, ist eine revolutionäre Gentechnologie, die aus den natürlichen Immunsystemen von Bakterien und Archaeen stammt. Dieses System ist ein entscheidender Bestandteil der prokaryotischen Immunabwehr, das es diesen Organismen ermöglicht, Fragmente viraler DNA zu erfassen und sie zu nutzen, um ähnliche virale Sequenzen während nachfolgender Infektionen zu erkennen und zu zerstören. Im Wesentlichen ermöglicht CRISPR Viren, ihr genetisches Material in Bakterien zu integrieren und die zelluläre Maschinerie der Bakterien zu nutzen, um ihre eigenen Gene zu replizieren, einen Prozess, den wir als Gentechnik bezeichnen.
Die Hauptbestandteile des CRISPR-Systems umfassen:
- CRISPR-LociDiese Loci bestehen aus sich wiederholenden genetischen Sequenzen, die mit "Spacer"-Sequenzen durchsetzt sind, das sind Fragmente von viraler DNA, die aus früheren Infektionen stammen.
- Cas-Proteine (CRISPR-assoziierte Proteine)Cas9 ist beispielsweise ein Enzym, das DNA an bestimmten Stellen schneiden kann, geleitet von RNA-Sequenzen.
- Leit-RNA (gRNA)Dies ist eine kurze RNA-Sequenz, die komplementär zur Ziel-DNA-Sequenz ist und das Cas9-Enzym an die genaue Stelle im Genom lenkt, an der eine Bearbeitung gewünscht ist.
Was ist das CRISPR-Cas9-System?
Das CRISPR-Cas9-Gentargeting-System, das zwei Komponenten erfordert: eine maßgeschneiderte Leit-RNA (sgRNA, bestehend aus einer ziel-spezifischen crRNA-Sequenz und tracrRNA) und eine unspezifische CRISPR-assoziierte Endonuklease (Cas9), ist ein neues Werkzeug zur Genom-Engineering, das es Forschern ermöglicht, Teile des Genoms zu bearbeiten, indem sie einen Abschnitt der DNA-Sequenz in Organismen entfernen, hinzufügen oder verändern. Es ist derzeit die einfachste, vielseitigste, präziseste und effektivste Methode der genetischen Manipulation, die viele potenzielle Anwendungen, einschließlich Medizin und Verbesserung von Pflanzensamen, hat. CRISPR-Cas9 wurde auch angepasst, um hochdurchsatzfähige Genom-Editing zu ermöglichen und hat die Erzeugung gezielter Mutationen revolutioniert.
Einführung in die CRISPR-Sequenzierung
CRISPR-Sequenzierung ist eine fortschrittliche Methodik, die die CRISPR-Gentechnologie mit Hochdurchsatz-Sequenzierung, die darauf abzielt, das Genom präzise zu manipulieren und die resultierenden Effekte zu analysieren. CRISPR, ein Akronym für Clustered Regularly Interspaced Short Palindromic Repeats, stammt aus einem bakteriellen Immunsystem und verwendet Cas (CRISPR-assoziierte) Proteine, die von spezifischen RNA-Molekülen geleitet werden, um DNA-Sequenzen zu zielen und zu bearbeiten. Diese Technik ermöglicht nicht nur gezielte Genomänderungen, sondern auch umfassende nachgelagerte Analysen und bietet erhebliches Potenzial sowohl in der Grundlagenforschung als auch in der angewandten Biotechnologie.
In CRISPR-Experimenten ist die Validierung genetischer Änderungen von größter Bedeutung. NGS bietet einen unkomplizierten, hochdurchsatzfähigen Ansatz zur Untersuchung gewünschter Mutationen, angesichts der möglichen Vorkommen von Off-Target-Modifikationen anstelle der beabsichtigten Genänderungen. Die CRISPR-Amplicon-Sequenzierung hat sich zur standardisierten Validierungstechnik in akademischen, klinischen und industriellen Bereichen entwickelt. Hochdurchsatz-CRISPR-Screening nutzt die Prinzipien der gezielten Amplicon-Sequenzierung, indem Primer verwendet werden, die die Zielregionen für die PCR-Amplifikation flankieren. Die gezielte Amplicon-Sequenzierung ist die empfindlichste Methode zur Mutationsdetektion und kann Mutationen mit Frequenzen von bis zu 0,01 % identifizieren.
Um den aufkommenden Bedürfnissen der Forschungsgemeinschaften gerecht zu werden, hat CD Genomics eine kostengünstige, zuverlässige und hochdurchsatzfähige Strategie zur Screening und Validierung von CRISPR-Cas9-basierten Mutationen entwickelt, indem ampliconbasierte Next-Generation-Sequenzierung genutzt wird. Unser CRISPR-Next-Generation-Sequenzierungsdienst kann Ihnen direkte und detaillierte Informationen über die Natur und Vielfalt der Mutationen liefern, einschließlich der Bestätigung von Knockout/Knockin-Allel, der Bewertung der Schneideeffizienz von sgRNAs, der Identifizierung von homozygoten und heterozygoten Varianten sowie der Berechnung von Mutationsfrequenzen. u. a..
Vorteile unseres CRISPR-Sequenzierungsdienstes
- Die hohe Präzision des CRISPR/Cas9-Systems ermöglicht eine genaue Zielauswahl und Bearbeitung spezifischer genomischer Loci.
- Diese Vielseitigkeit ermöglicht eine Vielzahl von genomischen Modifikationen, einschließlich Gen-Knockouts, Knock-ins, Punktmutationen und Genregulation.
- Umfangreiche Multiplexing-Flexibilität und Hochdurchsatz-Sequenzierung, bis zu 104 Proben pro Durchgang
- Ultra-tiefe Sequenzierung von Amplicons oder erfassten Regionen mit mehr als 1000-facher Abdeckung
- Kosteneffiziente und hochsensible Nachweisniveaus ohne Verzerrung
- Keine mühsamen und zeitaufwändigen Klonierungsschritte erforderlich.
- Engagierte Unterstützung von spezialisierten Wissenschaftlern auf Doktoratsniveau
Anwendungen der CRISPR-Sequenzierung
- Funktionelle Genomik: Dieses Fachgebiet untersucht die Genfunktion und die Rollen, die Gene in biologischen Prozessen spielen, und bietet ein umfassendes Verständnis der genomischen Beiträge zu verschiedenen zellulären Aktivitäten.
- Gentherapie: Mit dem Fokus auf die Behebung pathogener Mutationen, die für erbliche Krankheiten verantwortlich sind, zielt die Gentherapie darauf ab, die normale Genfunktion wiederherzustellen und die Krankheitssymptome zu lindern.
- Agrarbiotechnologie: Diese Disziplin umfasst die Verbesserung von Pflanzeneigenschaften, wie Krankheitsresistenz und Ertrag, durch genetische Modifikationen, wodurch die landwirtschaftliche Produktivität und Nachhaltigkeit gefördert wird.
- Krebsforschung: Der Krebsforschung widmet sich der Aufklärung der Rollen tumorassoziierter Gene, erforscht die Mechanismen der Onkogenese und des Krebsfortschritts und ebnet den Weg für neuartige therapeutische Strategien.
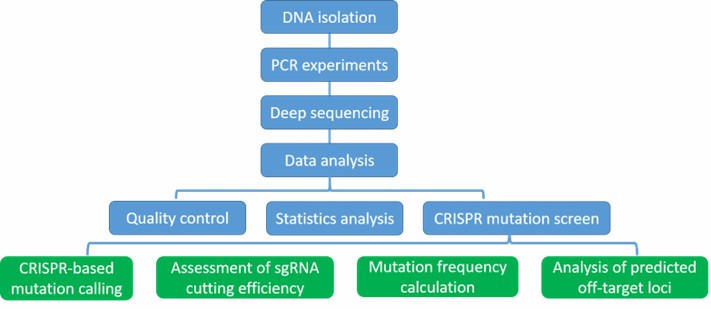
CRISPR-Sequenzierungs-Workflow
Unser hochqualifiziertes Expertenteam führt das Qualitätsmanagement nach jedem Verfahren durch, um umfassende und genaue Ergebnisse sicherzustellen. Unser CRISPR-Mutationssequenzierungs-Workflow ist unten aufgeführt und umfasst DNA-Isolierung, PCR-Experimente, Tiefensequenzierung und Datenanalyse. Unsere CRISPR-Mutationssequenzierung ermöglicht es Forschern, die Bibliothek der Leitfäden zu validieren, CRISPR/Cas9-Ziele und Mutationseffizienz zu validieren sowie die vielversprechendsten Zielstandorte zu entdecken.

Dienstspezifikationen
Musteranforderungen
|
|
Sequenzierungsstrategie
|
|
| Bioinformatikanalyse
Wir bieten mehrere maßgeschneiderte bioinformatische Analysen an:
|
Analyse-Pipeline
Genom-Editierung mit CRISPR: Wie man Off-Target-Effekte effektiv minimiert
Liefergegenstände
- Die ursprünglichen Sequenzierungsdaten
- Experimentelle Ergebnisse
- Datenanalysebericht
- Details zur CRISPR-Sequenzierung für Ihr Schreiben (Anpassung)
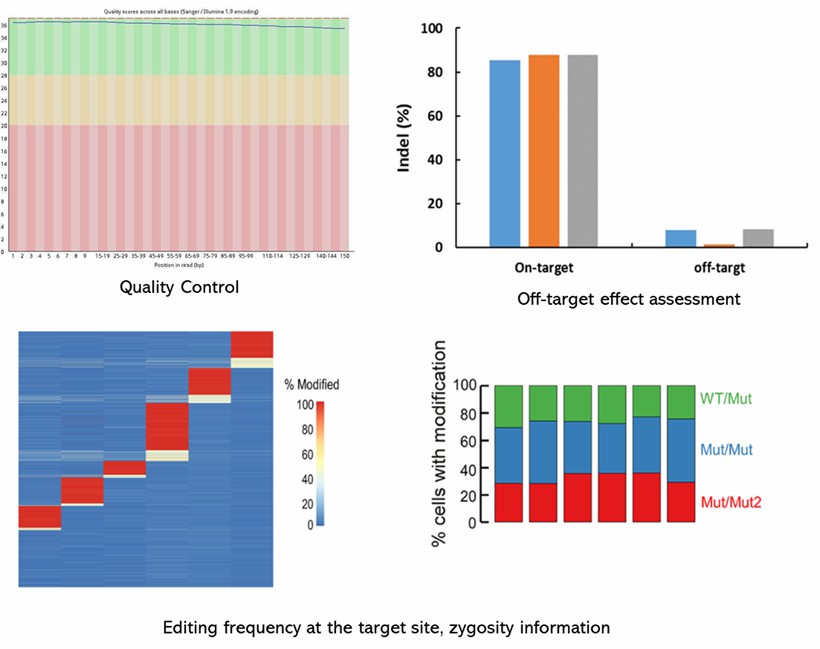
CD Genomics bietet umfassende Dienstleistungen zur Erkennung potenzieller Off-Target-Effekte durch gezielte Anreicherung und tiefes Sequenzieren, alles zu wettbewerbsfähigen Preisen. Unsere fortschrittlichen Fähigkeiten ermöglichen es uns, Hunderte von Proben gleichzeitig zu sequenzieren, was eine effiziente Verarbeitung und hohe Durchsatzraten gewährleistet. Die Verteilungsmuster von Insertionen und Deletionen (InDels) werden sorgfältig analysiert, und Mutationen werden mit dem robusten CRISPResso-Tool verifiziert. Sollten Sie weitere Anforderungen oder Anfragen haben, zögern Sie bitte nicht, uns zu kontaktieren.
Teilweise Ergebnisse sind unten aufgeführt:
1. Ist CRISPR-Cas9 Next-Generation-Sequencing?
Next-Generation-Sequenzierung (NGS) spielt eine integrale Rolle in verschiedenen Phasen der CRISPR-Cas9-Genom-Editing-Workflows. Die Anwendungen reichen von umfassender Genomsequenzierung zur Analyse potenzieller Off-Target-Effekte von CRISPR bis hin zu gezielter Sequenzierung, die darauf abzielt, spezifische Gen-Knockouts und andere Änderungen zu bestätigen. Durch den Einsatz von NGS können Forscher eine detaillierte und präzise Validierung der durch CRISPR induzierten Modifikationen erreichen, um die Genauigkeit und Zuverlässigkeit ihrer genetischen Veränderungen sicherzustellen.
2. Was sind die ethischen Überlegungen zur CRISPR-Sequenzierung?
CRISPR-Sequenzierung wirft ethische Bedenken auf, insbesondere hinsichtlich des Potenzials für Off-Target-Mutationen und der Implikationen von Keimbahnänderungen. Ethische Richtlinien betonen die Notwendigkeit strenger Sicherheitsbewertungen, informierter Zustimmung und Transparenz in der Forschung, die Technologien zur Genbearbeitung betrifft.
3. Wie stellen Forscher die Spezifität der CRISPR-Sequenzierungsergebnisse sicher?
Forscher verwenden bioinformatische Werkzeuge, um Sequenzierungsdaten zu analysieren und echte durch CRISPR induzierte Mutationen von Hintergrundrauschen oder Sequenzierungsfehlern zu unterscheiden. Darüber hinaus kommen Validierungstechniken wie Sanger-Sequenzierung oder Tropfen digitaler PCR (ddPCR) kann das Vorhandensein von Mutationen an spezifischen genomischen Loci bestätigen.
4. Wie wird CRISPR-Sequenzierung in der klinischen Forschung und Therapie eingesetzt?
Im Bereich der klinischen Forschung spielt das CRISPR-Sequenzieren eine wesentliche Rolle bei der Weiterentwicklung therapeutischer Perspektiven für genetische Erkrankungen. Diese Technologie ermöglicht die präzise Validierung genomischer Modifikationen in patientenabgeleiteten Zellen, wodurch Forscher die Wirksamkeit und Sicherheitsprofile von Gentherapien vor klinischen Studien gründlich untersuchen können. Darüber hinaus ist das CRISPR-Sequenzieren entscheidend für die Aufklärung von Krankheitsmechanismen und die Identifizierung potenzieller therapeutischer Ziele, was ein tieferes Verständnis fördert, das die Entwicklung innovativer Behandlungsstrategien vorantreiben kann.
Genomweite Off-Target-Analysen der CRISPR/Cas9-vermittelten T-Zell-Rezeptor-Engineering in primären menschlichen T-Zellen
Journal: Klinische & Translationale Immunologie
Impactfaktor: 5,8
Veröffentlicht: 23. Januar 2022
Hintergrund
Die Nutzung von T-Zellen zur Bekämpfung von Krebs ist ein herausragender Ansatz in modernen immuntherapeutischen Strategien. Die genetische Veränderung von T-Zell-Rezeptoren (TCRs) ermöglicht die Umleitung der T-Zell-Spezifität, die Eliminierung von Alloreaktivität und den Fortschritt der adoptiven T-Zell-Transfertherapie (ACT). Die Einführung von DNA-Doppelstrangbrüchen durch CRISPR/Cas9-Technologie erleichtert Gen-Knockout- oder Knock-in-Manipulationen. Eine effektive Methode zur Feststellung der Sicherheit von konstruierten T-Zellen besteht in der Erkennung von Off-Target-Genen im gesamten Genom. Mithilfe von CRISPR/Cas9-Techniken verwendeten die Autoren die Lieferung von Ribonukleoproteinen, um den TCR auszuschalten, was es ihnen ermöglichte, die Sicherheit genetisch veränderter T-Zellen zu bewerten. Whole-Genome-Sequenzierung wurde anschließend beauftragt zu untersuchen, ob durch CRISPR/Cas9 vermittelte Doppelstrangbrüche an TCR-Stellen mit Off-Target-Effekten in primären T-Zellen verbunden sind.
Materialien & Methoden
Probenvorbereitung
- Mensch
- T-Zelle
- TCR-Knockout
Sequenzierung
- Whole-Genome-Sequenzierung (WGS)
- Gezielte Tiefensequenzierung
- Analyse von Cas9-Off-Target-Stellen
- Analyse der vorhergesagten Cas9-Off-Target-Stellen
- Analyse des durch Elektroporation bedingten Anstiegs der Mutationsrate
Ergebnisse
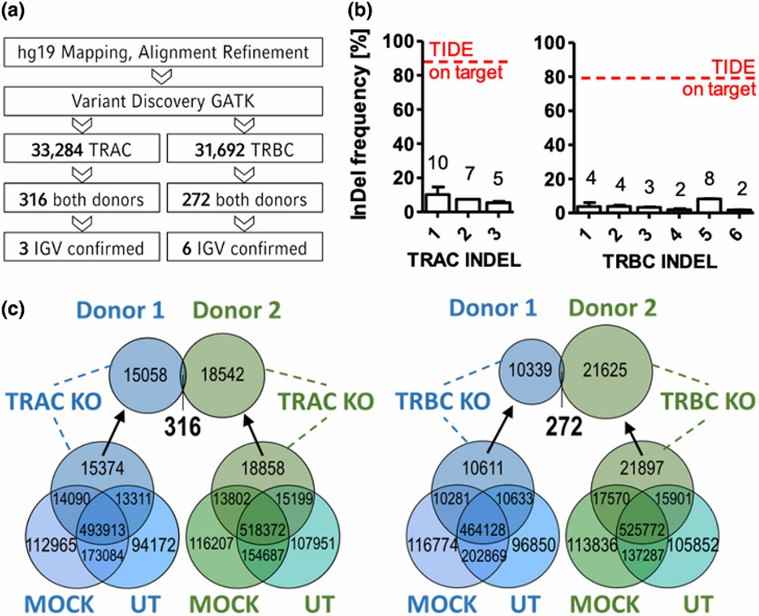 Abb. 1. Ganzgenomanalyse der gRNA-abhängigen Cas9-induzierten Off-Target-Effekte.
Abb. 1. Ganzgenomanalyse der gRNA-abhängigen Cas9-induzierten Off-Target-Effekte.
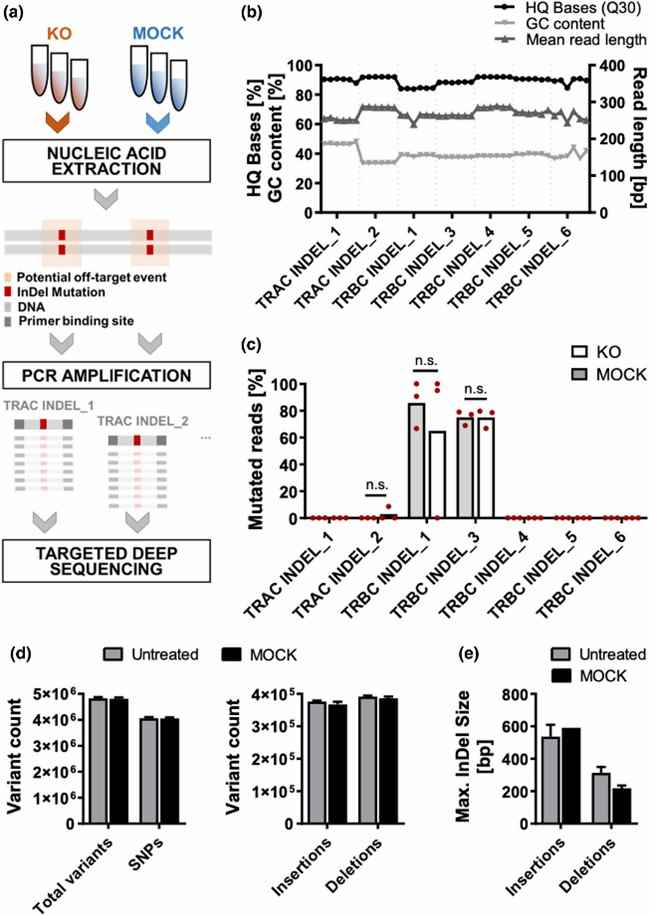 Abb. 2. Zielgerichtete Tiefensequenzierung von WGS-vorab identifizierten Off-Target-Ereignissen.
Abb. 2. Zielgerichtete Tiefensequenzierung von WGS-vorab identifizierten Off-Target-Ereignissen.
Die Sicherheit der T-Zellen wurde durch die Untersuchung von unspezifischen Nuklease-induzierten Off-Target-Vorfällen bewertet. Mithilfe von Cas-OFFinder durchsuchten die Autoren nach übereinstimmenden Stellen mit einer Fehlpaarung von ≤ 4 zwischen der Leit-RNA (gRNA) und der Nicht-Ziel-DNA, die als mögliche Off-Target-Standorte betrachtet wurden. Anschließend wurde eine Ganzgenomsequenzierung sowohl an unbehandelten Proben als auch an MOCK-Proben durchgeführt. Die Ergebnisse zeigten, dass die Elektroporation allein keine signifikanten genomischen Variationen hervorrief.
Die Autoren führten dann eine Ganzgenomsequenzierung an Proben durch, die TRAC- und TRBC-Bearbeitungen unterzogen wurden, wobei die InDels ausgeschlossen wurden, die in unbehandelten und MOCK-Proben gefunden wurden. Durch die Anwendung einer Ganzgenom-homologen Sequenzanpassung basierend auf der Einzelguide-RNA (sgRNA) identifizierten sie 316 distincte InDels in den TRAC-bearbeiteten Proben und 272 distincte InDels in den TRBC-bearbeiteten Proben. Diese potenziellen Off-Target-Stellen wurden anschließend von den Autoren zusammengestellt.
Fazit
Zusammenfassend untersucht diese Studie die Sicherheit der CRISPR/Cas9-vermittelten genetischen Veränderung von T-Zell-Rezeptoren (TCR) mit dem Ziel, Off-Target-Effekte zu bewerten. Durch einen kombinierten Ansatz aus gezielter Zielvorhersage, unvoreingenommener Ganzgenomsequenzierung und gezielter Tiefensequenzierung bestätigte die Studie eine hohe Effizienz beim TCR-Knockout, ohne dass CRISPR/Cas9-induzierte Off-Target InDel-Mutationen nachgewiesen wurden. Weitere in vivo-Forschung ist jedoch notwendig, um die klinische Sicherheit genetisch veränderter T-Zell-Produkte vollständig zu bewerten.
Referenz
- Kaeuferle T, Stief T A, Canzar S, et al. Genomweite Off-Target-Analysen der CRISPR/Cas9-vermittelten T-Zell-Rezeptor-Engineering in primären menschlichen T-Zellen. Klinisch & Translational Immunologie, 2022, 11(1): e1372.
Hier sind einige Publikationen, die erfolgreich mit unseren Dienstleistungen oder anderen verwandten Dienstleistungen veröffentlicht wurden:
Die HLA-Klasse-I-Immunopeptidome der AAV-Kapsidproteine
Zeitschrift: Frontiers in Immunology
Jahr: 2023
Isolation und Charakterisierung neuer menschlicher Trägerpeptide aus zwei wichtigen Impfstoffimmunogenen
Zeitschrift: Impfstoff
Jahr: 2020
Änderung von Gewicht, BMI und Körperzusammensetzung in einer bevölkerungsbasierten Intervention im Vergleich zu einer genetisch basierten Intervention: Die NOW-Studie
Journal: Fettleibigkeit
Jahr: 2020
Sarecyclin hemmt die Proteintranslation im Cutibacterium acnes 70S-Ribosom durch einen Zwei-Stellen-Mechanismus.
Zeitschrift: Nucleic Acids Research
Jahr: 2023
Identifizierung eines Darmkommensalen, der die blutdrucksenkende Wirkung von Ester-Angiotensin-Converting-Enzym-Hemmern beeinträchtigt.
Zeitschrift: Hypertonie
Jahr: 2022
Eine Splice-Variante im SLC16A8-Gen führt zu einem Defizit beim Laktattransport in aus menschlichen iPS-Zellen abgeleiteten retinalen Pigmentepithelzellen.
Zeitschrift: Zellen
Jahr: 2021
Mehr anzeigen Artikel, die von unseren Kunden veröffentlicht wurden.


 Richtlinien zur Einreichung von Proben
Richtlinien zur Einreichung von Proben
